Cet article traite de la surveillance clinique et paraclinique, et du suivi des biothérapies du psoriasis administrables par voie sous-cutanée (anti-TNF étanercept Enbrel et adalimumab Humira, anti-IL-12/13 ustékinumab Stelara) après introduction de la biothérapie, en dermatologie libérale de ville. En effet, les biomédicaments ne sont pas restreints au monde hospitalier. Les dermatologues libéraux formés à leur prescription sont à même de poursuivre, en ville, le suivi de leurs patients psoriasiques les plus sévères.
Si les biothérapies sont légalement pres-crites par un dermatologue hospitalier (prescription initiale hospitalière ou PIH), elles peuvent être renouvelées régulièrement par un dermatologue libéral. La prescription initiale peut être réalisée par tout médecin hospitalier (hospitalier à plein temps ou exerçant une vacation hospitalière sur délégation du responsable de service), sur ordonnance bleue de médicament d’exception. La PIH est valable un an. Au terme de cette période, une nouvelle prescription hospitalière est requise légalement pour permettre la poursuite du suivi libéral.
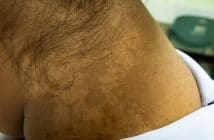
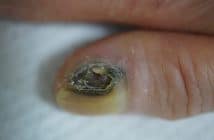
La surveillance des biomédicaments en ville se fonde sur les risques associés. Le principal effet secondaire est infectieux. La tuberculose sous anti-TNF est devenue rare depuis les mesures de dépistage efficaces de la tuberculose latente, avant traitement, et les mesures de chimioprophylaxie antitubercu-leuse (rifadine + isoniazide 3 mois) en cas de tuberculose latente. La principale crainte est l’infection bactérienne, qui est surtout de forme commune (pneumonies, infections urinaires, dermo-hypodermites). Les vastes études épidémiologiques n’ont pas montré de surrisque de néoplasie solide sous biomédicament, hormis un risque un peu accru de cancers cutanés de type carcinome et méla-nome [1]. Les autres effets secondaires (hépatites, cytopénies, pathologies auto-immunes, pathologies démyélinisantes de type SEP, insuffisance cardiaque) restent exceptionnels.
Fort heureusement, les événements indésirables sous biomédicament sont rares. Ainsi, si l’on s’appuie sur la vaste étude de tolérance de l’adalimumab Humira de Burmester et al. (23 458 patients toutes indications), qui rapporte l’incidence de chaque effet secondaire pour 100 patients traités par adalimumab sur 1 an [2, 3], la fréquence est la suivante : infection bactérienne 1,7/100 patients-années (PA) ; tuberculose 0,1/100 PA, soit 1 sur 1 000 ; cancer cutané 0,2/100 PA ; cancer non cutané 0,7/100 PA (identique à la population générale de référence). Les événements indésirables sous biothérapie sont donc d’ordre infectieux, de survenue brutale, peu prévisibles et non détectables par une surveillance biologique régulière. Il faut informer le patient de ce risque, et l’inviter à suspendre son traitement et à consulter en urgence un médecin (dermatologue ou médecin[...]
Connectez-vous pour consulter l'article dans son intégralité.
Vous êtes abonné(e)
IDENTIFIEZ-VOUS
Pas encore abonné(e)
INSCRIVEZ-VOUS
Inscrivez-vous gratuitement et profitez de tous les sites du groupe Performances Médicales
S'inscrire